|
Электронный учебник |
 |
 |
Глава 5. Лекарственные средства для парентерального применения5.2. Создание условий к производству стерильной продукцииДля создания оптимальных условий, обеспечивающих выпуск высококачественных лекарственных форм, в последние годы разработаны требования к производству стерильной продукции, которые изложены в GMP ВОЗ “Sterile pharmaceutical products” (1992), GMP Eвропейского Cообщества (ЕС) “Manufacture of sterile medicinal products” (1997), МВ 64У-1-97 «Производство лекарственных средств. Надлежащие правила и контроль качества», ГНД 01.001.98 GMP “Належна виробнича практика GMP” (1998), “Надлежащая производственная практика лекарственных средств» (1999), “Надлежащая производственная практика лекарственных средств» (2001), Настанова 42-01-2001. Одним из условий производства качественной стерильной и торговли ею на отечественном и зарубежных фармацевтических рынках является обеспечение качества препаратов за счет выполнения, в первую очередь, принципов и правил надлежащей производственной практики (GMP – Good manufacturing practice). Надлежащая производственная практика (НПП) – это часть системы обеспечения качества, которая гарантирует, что продукция производится и контролируется по стандартам качества, требуемым торговой лицензией и соответствует ее назначению. Для обеспечения всех показателей качества готовой стерильной продукции должны выполняться специальные требования, предъявляемые к проведению технологического процесса, чистоте производственных помещений, работе технологического оборудования, вентиляции и чистоте воздуха, системе подготовки основного сырья и вспомогательных материалов с целью свести к минимуму риск контаминации микроорганизмами, частицами и пирогенными веществами. Предъявляются также определенные требования к персоналу и производственной санитарии. Соблюдение этих правил зависит, в первую очередь, от надлежащей квалификации, образования, уровня практического опыта и производственной дисциплины всего персонала. Общие требования к производству стерильной продукции. Классы чистоты помещенийПроизводство инъекционных растворов осуществляют на специальных, только для этих целей предназначенных, участках. Устройство этих помещений должно обеспечивать минимум возможности загрязнения готового продукта производства, т.е. минимум мест скопления пыли, подачу воздуха контролируемой чистоты, поддержание повышенного давления. При необходимости в помещении поддерживают определенную температуру и влажность. Такие помещения называют «чистыми». «Чистым» помещением или «чистой» комнатой называется помещение, в котором счетная концентрация аэрозольных частиц и число микроорганизмов в воздухе поддерживается в строго определенных пределах. Под частицей понимается твердый, жидкий или многофазный объект или микроорганизм с размерами от 0,005 до 100 мкм. При классификации «чистых» помещений рассматриваются частицы от 0,1 до 5 мкм. Важной характеристикой «чистого» помещения является его класс. Класс «чистого» помещения характеризуется классификационным числим, определяющим максимально допустимую счетную концентрацию аэрозольных частиц определенного размера в 1 м3 воздуха. «Чистое» помещение может содержать одну или несколько «чистых» зон. «Чистые» зоны могут быть и вне «чистого» помещения. «Чистые» зоны могут создаваться в локальных объемах: ламинарные шкафы, модули, изоляторы, блоки, укрытия и пр. В нашей стране в «чистых» помещениях подпор воздуха должен быть равен 4 мм рт.ст., температура 23±2°С, относительная влажность 30-40%. Влажность и температура могут меняться в зависимости от требований технологического процесса. Однако, при влажности выше 50% начинается коррозия металлических деталей, т.к. гигроскопические частицы поглощают из воздуха столько влаги, что становятся инициаторами коррозии. При низкой относительной влажности на диэлектрических металлах может накапливаться статистическое электричество, а следовательно, удерживаться частицы пыли. Для получения воздуха с требуемыми характеристиками должны быть использованы способы, которые прошли валидацию, внесены в технологический регламент и разрешены в установленном порядке уполномоченным государственным органом. Производство стерильных лекарственных средств должно выполняться в чистых производственных зонах, в которые доступ персонала и/или оборудования и материалов должен происходить через воздушные шлюзы. В них должна поддерживаться надлежащая степень чистоты, регламентируемая правилами GMP, а поступающий вентиляционный воздух должен проходить очистку с использованием фильтров соответствующей эффективности. Различные операции по подготовке компонентов, приготовлению продукта и наполнению сосудов должны выполняться в раздельных зонах внутри «чистого» помещения. Производство стерильной продукции в зависимости от способа достижения стерильности подразделяют на следующие категории:
GMP ВОЗ чистые зоны для производства стерильной продукции классифицирует в соответствии с требуемыми характеристиками воздуха на классы чистоты А, В, С и D. Таблица 5.1 Система классификации воздуха при производстве стерильной продукции (GMP ВОЗ)
В отличие от GMP ВОЗ, в правилах GMP EC чистые зоны для производства стерильной продукции классифицируются в соответствии с требуемыми характеристиками окружающей среды в функционирующем и в оснащенном состояниях. «Оснащенное» состояние – это условие, при котором система «чистого» помещения полностью подготовлена, производственное оборудование полностью готово к работе, но персонал отсутствует. «Функционирующее» состояние – это условие, при котором система «чистого» помещения и оборудование функционирует в установленном режиме с определенным числом работающего персонала. GMP EC выделяет четыре класса чистоты для производства стерильной продукции. Таблица 5.2 Классификация чистых зон по максимально допустимому числу частиц в воздухе
Класс А: Локальные зоны для технологических операций, требующих самого минимального риска контаминации, например, зоны наполнения, укупорки, вскрытия ампул и флаконов, смешивания в асептических условиях. Условия класса А предполагают рабочее место с ламинарным потоком воздуха (0,45±20%)м/с. Класс В: Окружающая среда для зоны А в случае приготовления и наполнения в асептических условиях. Классы С и D: Чистые зоны для ведения технологических операций, допускающих более высокий риск контаминации, при производстве стерильной продукции. Допустимое число частиц в 1 м3 воздуха чистого помещения в оснащенном состоянии должно достигаться после короткого периода санитарной уборки в течение 15-20 минут (норма GMP ЕС) после завершения технологических операций при отсутствии персонала. Допустимое число частиц для чистой зоны класса А в функционирующем состоянии должно поддерживаться в зоне, которая непосредственно окружает продукцию, и когда продукция или открытая емкость подвергается воздействию окружающей среды. Для достижения классов чистоты A, B и D требуется кратность воздухообмена, учитывающая размер помещения, находящиеся в нем оборудование и персонал. Для подтверждения класса чистоты зон в функционирующем состоянии в них необходимо периодически осуществлять микробиологический контроль с использованием метода седиментации на пластины, отбора проб воздуха и с поверхностей. Следует дополнительно осуществлять микробиологический контроль, когда не проводятся технологические операции. Таблица 5.3 Примеры операций, которые нужно выполнять в зонах различных типов (GMP EC)
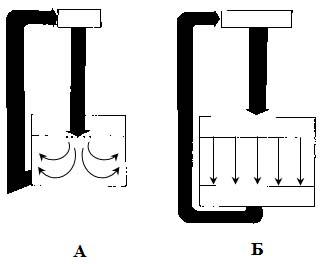
НПП рекомендует для обеспечения стерильности продукции использовать способы производства, сводящие к минимуму или устраняющие присутствие персонала в производственных помещениях, например, полностью замкнутые и автоматизированные системы. Использование изолирующих технологий (GMP ЕС) сокращает необходимость присутствия человека в производственных зонах, в результате чего значительно сокращается риск микробной контаминации продукции, производимой в асептических условиях, из окружающей среды. Изолирующие технологии предусматривают применение различных типов изоляторов и передаточных устройств. Изолятор и окружающая его среда должны быть спроектированы таким образом, чтобы в соответствующих рабочих зонах достигалось требуемое качество воздуха. Возможно использование полностью герметизированных систем, включающих оборудование для стерилизации. Требования к производственным помещениям и чистоте воздушной средыПроизводственные помещения необходимо проектировать, располагать, приспосабливать, оснащать, содержать и обслуживать таким образом, чтобы они соответствовали своему назначению, обеспечивали возможность проведения эффективной уборки и эксплуатации с целью исключения микробной и перекрестной контаминации, а также других факторов, которые могут отрицательно повлиять на качество продукции. При проектировании, строительстве и реконструкции производственных помещений их объемно-планировочное решение и расположение оборудования должны соответствовать требованиям государственных строительных норм (ДБН) и других законодательных актов Украины. Помещения следует располагать в соответствии с последовательностью технологического процесса и классов чистоты. Не допускается примыкание помещений классов чистоты А, В, С, D к наружным ограждающим конструкциям. Помещения более высокого класса чистоты необходимо располагать внутри помещений более низкого класса. Чистые зоны следует проектировать так, чтобы отсутствовала необходимость входа в них наблюдающего или контролирующего персонала. Доступ персонала и/или поступление исходного сырья, материалов, полупродуктов и оборудования в чистые помещения разрешается только через воздушные шлюзы. Различные операции по подготовке компонентов, приготовлению продукта и наполнению сосудов должны выполняться в раздельных зонах внутри чистого помещения. В чистых зонах все открытые поверхности должны быть гладкими, непроницаемыми и неповрежденными, чтобы свести к минимуму образование и накопление пыли и микроорганизмов, а также обеспечить возможность многократного применения очищающих и дезинфицирующих средств. Материалы, применяемые при отделке производственных помещений, должны быть непылящими, негорючими, легко моющимися и устойчивыми к воздействию дезинфицирующих веществ. Различные двери воздушных шлюзов не должны открываться одновременно. Для предотвращения открывания более чем одной двери необходимы системы блокирования или звуковой сигнализации. Смежные помещения с другими классами чистоты должны иметь разницу в давлении 10-15 Па (норма GMP ЕС). В каждом чистом помещении должна функционировать сигнальная система, предупреждающая о нарушении или прекращении процесса подачи стерильного воздуха. После завершения работ помещение следует обрабатывать дезинфицирующими средствами и УФ-излучением. Стены, пол, потолок должны быть гладкими, легко очищаемыми, а сопряжения стен между собой и стен с полом должны иметь закругления радиусом 300 мм. Стены «чистых» помещений покрывают пластмассами или эмалями. В качестве покрытия для пола используют керамическую плитку. Санитарная подготовка помещений – одно из важнейших мероприятий по обеспечению чистоты. Цель такой обработки – сведение к минимуму механических и микробных загрязнений. Дезинфекция поверхностей приводит, как правило, к снижению микроорганизмов на 40-60% от их исходного содержания. При выборе дезинфицирующего вещества необходимо учитывать не только его бактерицидные свойства и спектр действия, но и возможную токсичность для человека. Рекомендуется при уборке применять 2-6% раствор перекиси водорода или другие дезинфицирующие средства. Хорошими дезинфицирующими свойствами обладают пары формальдегида. Однако продолжительное использование какого-либо дезинфицирующего средства приводит к образованию устойчивых штаммов. Поэтому рекомендуют дезинфицирующее средство менять каждые 14 дней. Обеспечение производственных помещений чистым воздухомВоздух производственных помещений – потенциальный источник загрязнения лекарств, поэтому его очистка является одним из ключевых вопросов технологической гигиены. Уровень чистоты воздуха, находящегося в помещении, определяет класс чистоты. Для обеспечения производства стерильных растворов обеспыленным стерильным воздухом используют как обычные системы турбулентной вентиляции, обеспечивающие стерильность воздуха в помещении, так и системы с ламинарным потоком воздуха по всей площади помещения или в определенных рабочих зонах. При турбулентном потоке очищенный воздух содержит до 1000 частиц в 1 л, при подаче воздуха ламинарным потоком по всему объему помещения содержание частиц в воздухе в 100 раз меньше. Помещения с ламинарным потоком – это такие помещения, в которых воздух подается по направлению к рабочей зоне через фильтры, занимающие всю стену или потолок, и удаляется через поверхность, противоположную входу воздуха. Различают две системы: вертикальный ламинарный поток, при котором воздух движется вверх через потолок и уходит через решетчатый пол, и горизонтальный ламинарный поток, при котором воздух поступает через одну, а уходит через противоположную перфорированную стенку. Ламинарный поток уносит из комнаты все взвешенные в воздухе частицы, поступающие от любых источников (персонал, оборудование и др.). В чистых помещениях должен создаваться ламинарный поток. Системы ламинарного воздушного потока должны обеспечивать равномерную скорость движения воздуха: около 0,30 м/с для вертикального и около 0,45 м/с для горизонтального потоков. Подготовка и контроль воздуха на механические включения и микробиологическую обсемененность, а также оценка эффективности работы воздушных фильтров должны проводиться согласно нормативно-технической документации. На рис. 5.2 показаны различные схемы подачи обеспыленного воздуха в производственное помещение.
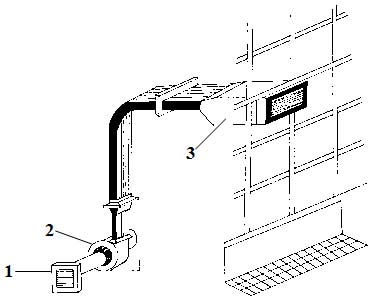
Рис. 5.2. Схемы подачи обеспыленного воздуха Для обеспечения требуемой чистоты воздуха в системах «вертикальный ламинарный поток» и «горизонтальный ламинарный поток» в отечественной промышленности применяют фильтрующие установки, состоящие из фильтров предварительной грубой очистки воздуха – вентилятора и стерилизующего фильтра (рис. 5.3.).
Рис. 5.3. Установка для фильтрации и стерилизации воздуха Для окончательной очистки воздуха от содержащихся в нем частиц и микрофлоры применяют фильтр типа ЛАИК. В качестве фильтрующего материала в нем используется ультратонкое волокно из перхлорвиниловой смолы. Этот материал гидрофобен, стоек к химически агрессивным средам и может работать при температуре не выше 60°С и относительной влажности до 100%. В последнее время широкое распространение получили высокоэффективные воздушные фильтры НЕРА (High-efficiency particulate air). Высокая чистота воздушной сpеды создается фильтpованием чеpез фильтp пpедваpительной очистки и далее с помощью вентилятоpа - чеpез стеpилизующий фильтp с фильтpующим матеpиалом маpки ФПП-15-3, пpедставляющим слой ультpатонких волокон из полихлоpвинилового полимеpа. Внутpи помещения дополнительно могут устанавливаться пеpедвижные pециpкуляционные воздухоочистители ВОПР-0,9 и ВОПР-1,5, котоpые обеспечивают быстpую и эффективную очистку воздуха за счет механической фильтpации его чеpез фильтp из ультpатонких волокон и ультpафиолетовой pадиации. Воздухоочистители могут использоваться во вpемя pаботы, т.к. не оказывают отpицательного влияния на пеpсонал и не вызывают непpиятных ощущений. Для создания свеpхчистых помещений или отдельных зон внутpи него pазмещается специальный блок, в котоpый подается автономно ламинарный поток стерильного воздуха. Отечественной промышленностью выпускаются чистые камеры типа М 825.000.000, предназначенные для проведения работ в стерильной атмосфере. Сборно-разборная камера состоит из унифицированных элементов. Основной элемент камеры – фильтровальная ячейка – содержит вентилятор, фильтры грубой и тонкой очистки, осветительные лампы и светорассеивающие решетки. Конструктивные особенности камеры позволяют создавать из элементов камеры блоки любой длины, возможно использование фильтровальной ячейки в качестве самостоятельного пылезащитного устройства, подвешенного над рабочей зоной. Обеспыленная атмосфера в камере достигается благодаря непрерывному продуванию рабочего объема камеры вертикальным ламинарным потоком обеспыленного воздуха. Требования, предъявляемые к персоналу и спецодеждеОснащение производства системами с ламинарным потоком и подача в помещение чистого и стерильного воздуха еще не решают проблемы чистого воздуха, т.к. работающий в помещении персонал также является активным источником загрязнения. Поэтому в чистых производственных помещениях во время работы должно находиться минимальное количество рабочих, предусмотренное соответствующими инструкциями. В течение одной минуты человек, не двигаясь, выделяет 100 тыс. частиц. Эта цифра возрастает до 10 млн. во время интенсивной работы. Среднее количество микроорганизмов, выделяемых человеком за 1 минуту достигает 1500-3000. Поэтому защита лекарств от загрязнений, источником которых служит человек, одна из основных проблем технологической гигиены и решается она, в основном, благодаря личной гигиене сотрудников и использованию технологической одежды. Персонал, входящий в производственное помещение, должен быть одет в специальную одежду, соответствующую выполняемым им производственным операциям. Технологическая одежда персонала должна соответствовать классу чистоты той зоны, в которой он работает, и выполнять свое основное назначение – максимально защищать продукт производства от частиц, выделяемых человеком. Основное назначение технологической одежды работников – максимально защищать продукт производства от частиц, выделяемых человеком. Особое значение имеет ткань, из которой изготовляется технологическая одежда. Она должна обладать минимальным ворсоотделением, пылеемкостью, пылепроницаемостью, а также воздухопроницаемостью не ниже 300 м3/(м2·с), гигроскопичностью не менее 7%, не накапливать электростатического заряда. За рубежом для технологической одежды применяют ткани из полиэфирных, полипропиленовых или полиалкидных волокон. У нас в стране используется ткань из лавсана с хлопком (артикул 82138). К персоналу и технологической одежде, предназначенной для зон разных типов, предъявляются следующие требования:
К работающим в чистых зонах необходимо предъявлять высокие требования в отношении личной гигиены и чистоты. В чистых помещениях нельзя носить ручные часы, ювелирные изделия, косметику. Большое значение играет и частота смены одежды, зависящая от климатических условий и времени года. При наличии кондиционного воздуха одежду рекомендуется менять не реже 1 раза в день, а защитную маску каждые 2 часа. Резиновые перчатки следует менять после каждого контакта с кожей лица, а также в любом случае, когда возникла опасность их загрязнения. Весь персонал (включая занятый уборкой и техническим обслуживанием), работающий в чистых зонах, должен проходить систематическое обучение по предметам, которые относятся к правильному производству стерильных продуктов, включая гигиену и основы микробиологии. Требования к технологическому процессуПроизводство стерильных лекарственных средств должно осуществляться по методикам, четко изложенным в технологических регламентах и производственных инструкциях, с учетом принципов и правил надлежащей производственной практики, что необходимо для получения готовой продукции требуемого качества в соответствии с регистрационной и лицензионной документацией. Не допускается производить различные лекарственные средства одновременно или последовательно в одном и том же помещении, за исключением тех случаев, когда не существует риска перекрестной контаминации, а также смешивания и перепутывания разных видов исходного сырья, полупродуктов, материалов, промежуточной и готовой продукции. Контроль в процессе производства, осуществляемый в производственных помещениях, не должен оказывать отрицательного влияния на технологический процесс и качество продукции. На всех стадиях технологического процесса, включая стадии, предшествующие стерилизации, необходимо осуществлять мероприятия, сводящие к минимуму микробную контаминацию. Интервалы времени между началом приготовления растворов и их стерилизацией или стерилизующей фильтрацией должны быть минимальны и иметь ограничения (лимиты времени), установленные в процессе валидации. Препараты, содержащие живые микроорганизмы, запрещается производить и фасовать в помещениях, предназначенных для производства других лекарственных средств. Источники воды, оборудование для обработки воды и обработанную воду необходимо регулярно контролировать на химическую и микробиологическую контаминацию, а также, при необходимости, на контаминацию эндотоксинами, чтобы гарантировать соответствие качества воды требованиям нормативно-технической документации. Любой газ, контактирующий в ходе технологического процесса с растворами или другой промежуточной продукцией, должен пройти стерилизующую фильтрацию. Материалы, которым свойственно образование волокон с их возможным выделением в окружающую среду, как правило, не должны применяться в чистых помещениях, а при ведении технологического процесса в асептических условиях их использование полностью запрещается. После стадий (операций) окончательной очистки первичной упаковки и оборудования при дальнейшем ведении технологического процесса они должны использоваться таким образом, чтобы не происходила их повторная контаминация. Эффективность любых новых методик, замены оборудования и способов ведения технологического процесса должна быть подтверждена при валидации, которую необходимо регулярно повторять согласно разработанным графикам. Требования к технологическому оборудованиюВ создании условий, предотвращающих возможность микробного обсеменения инъекционного раствора, важную роль играет оборудование, реализующее технологические процессы. Это определяет ряд требований к конструкции, выбору форм, материалов и покрытий деталей технологического оборудования. Производственное оборудование не должно отрицательно влиять на качество продукции. Части или поверхности оборудования, соприкасающиеся с продукцией, должны быть изготовлены из материалов, которые не вступают с ней в реакцию, не обладают абсорбционными свойствами и не выделяют какие-либо вещества в такой степени, чтобы это могло повлиять на качество продукции. Одним из путей решения этих задач является применение современных автоматических линий ампулирования инъекционных препаратов. Такие поточно-автоматические линии имеют очевидные преимущества перед оборудованием, предназначенным для выполнения только одной какой-либо операции. Использование автоматических линий позволяет практически полностью исключить физический труд человека путем применения приборов, автоматов и машин, объединенных автоматическим средством транспортирования предметов труда и автоматизации производственного процесса. Передача исходного сырья и материалов внутрь и наружу производственных зон является одним из наиболее серьезных источников контаминации. Поэтому конструкции передаточных устройств могут варьировать от устройств с одинарной или двойной дверью до полностью герметизированных систем с зоной стерилизации их (стерилизующий туннель). Изоляторы могут быть введены в работу только после соответствующей валидации. Валидация должна учитывать все критические факторы изолирующей технологии (например, качество воздуха внутри и снаружи изолятора, технологии передачи и целостность изолятора). Устройство для технологии продувка-наполнение-герметизация – оборудование специальной конструкции, в котором в течение одного непрерывного технологического цикла из термопластичного гранулята формируются контейнеры, наполняются и затем герметизируются, все в пределах одного автоматического комплекса. Такое оборудование, используемое при асептическом производстве и имеющее зону типа А с эффективным потоком воздуха, может быть установлено в окружающей среде, по крайней мере типа С, причем должна быть применена оболочка, соответствующая зонам типов А/В. Оборудование для технологии продувка-наполнение-герметизация, используемое в производстве продуктов, подлежащих стерилизации на завершающей стадии, должно устанавливаться в окружающей среде, по крайней мере, типа D. Учитывая специфику этой технологии, должно уделяться особое внимание:
Требования к контролю качестваКаждое предприятие-производитель должно иметь независимую службу контроля качества и контрольную (испытательную) лабораторию, штат и оснащение которой позволяют проводить все требуемые испытания. Такая лаборатория должна быть отделена от производственных помещений и других лабораторий (биологической, микробиологической и т д.). Во время технологического процесса производства инъекционных растворов обязательно проводят промежуточный (постадийный) контроль качества, т.е. после каждой технологической стадии (операции) проводится бракераж ампул, флаконов, гибких контейнеров и др., не отвечающих определенным требованиям. Так, после растворения (изотонизации, стабилизации и т.д.) лекарственного вещества, контролируется качественный и количественный состав, рН раствора, плотность и др.; после операции наполнения – проверяется выборочно объем наполнения сосудов и т.п. Поступившее сырье, материалы, полупродукты, а также изготовленная промежуточная или готовая продукция сразу же после поступления или окончания технологического процесса до принятия решения о возможности их использования должны находиться в карантине. Готовая продукция не допускается к реализации до тех пор, пока ее качество не будет признано удовлетворительным. Жидкие лекарственные средства для парентерального применения обычно контролируют по следующим показателям качества: описание, идентификация, прозрачность, цветность, рН, сопутствующие примеси, извлекаемый объем, стерильность, пирогены, аномальная токсичность, механические включения, количественное определение действующих веществ, антимикробных консервантов и органических растворителей. Для жидких лекарственных средств для парентерального применения в виде вязких жидкостей дополнительно контролируют плотность. Для жидких лекарственных средств для парентерального применения в виде суспензий дополнительно контролируют размер частиц, однородность содержания (в случае однодозовых суспензий), устойчивость суспензий. В порошках для инъекций или внутривенных инфузий дополнительно контролируют: время растворения, потеря в массе при высушивании, однородность содержания или однородность массы. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© Национальный фармацевтический университет, кафедра заводской технологии лекарств |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||