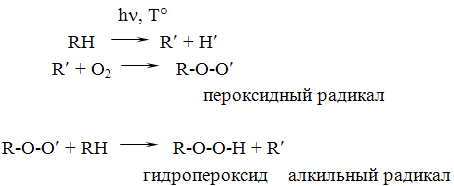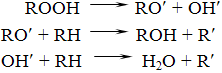|
Электронный учебник |
 |
 |
Глава 5. Лекарственные средства для парентерального применения5.8. Приготовление растворов для инъекцийТехнология инъекционных препаратов представляет собой сложное многостадийное производство, включающее как основные, так и вспомогательные процессы. Изготовление растворов для инъекций проводят в специальных помещениях первого или второго класса чистоты с соблюдением всех правил асептики. Приготовление водных или невязких растворов для инъекций проводят массообъемным методом, с использованием герметически закрываемых реакторов, снабженных рубашкой и перемешивающим устройством. В тех случаях, когда плотность растворителя значительно отличается от плотности воды, используют весовой метод, при котором и лекарственное вещество и растворитель берут по массе. Растворение медленно- или трудно растворяющихся лекарственных веществ ведут при нагревании и перемешивании. Стадия приготовления раствора включает следующие операции: растворение, изотонирование, стабилизация, введение консервантов, фильтрование. В зависимости от свойств лекарственных веществ некоторые из операций могут быть исключены, например, изотонирование, стабилизация, введение консервантов. Изотонирование инъекционных растворовСреди инъекционных растворов особую группу составляют изотонические, под которыми понимают растворы с осмотическим давлением, равным осмотическому давлению жидкостей организма (плазмы крови, лимфы, спинномозговой жидкости и т.д.). Осмотическое давление растворов является следствием теплового движения молекул растворенного вещества, стремящегося занять возможно больший объем. Оно в организме поддерживаются на постоянном уровне действием саморегуляторов. Осмотическое давление плазмы крови в норме держатся на уровне 72,52 × 104 Н/м2 (Па) или 7,4 атм. Растворы с меньшим осмотическим давление называются гипотоническими, с большим – гипертоническими. При введении большого количества растворов в виде внутрисосудистых инъекций осмотическое давление жидкостей организма нарушается. Объясняется это тем, что клеточные оболочки, обладая свойством полупроницаемости, пропускают воду и препятствуют проникновению многих растворенных в ней веществ. В связи с этим, если клетка снаружи окружена раствором с иным осмотическим давлением, чем давление внутри клетки, то происходит движение воды в клетку или из клетки до выравнивания концентрации, т.е. наблюдается явление осмоса. При введении в кровь гипертонического раствора (Рр-ра > Рвнутри клетки) – вода выходит из клетки. Она обезвоживается и наступает явление плазмолиза, при котором эритроциты сморщиваются. При введении гипотонического раствора (Рр-ра < Рвнутри клетки) жидкость переходит вовнутрь клетки до момента выравнивания концентрации. Клетка разбухает, клеточная оболочка при этом может лопнуть, а клетка погибнуть. Это явление носит название лизис, а для эритроцитов – гемолиз. Кроме того, внутримышечное и подкожное введение неизотонированных растворов вызывает боль, причем она тем сильнее, чем резче осмотическая разница. Поэтому при внутрисосудистом применении некоторых инъекционных растворов необходимо их изотонирование. Изотонические концентрации лекарственных веществ в растворах можно рассчитать следующими методами:
За рубежом пользуются также графическим методом расчета изотонических концентраций, позволяющим по разработанным номограммам быстро, но с некоторой приближенностью определить количество натрия хлорида, необходимое для изотонирования раствора лекарственного вещества. Метод, основанный на законе Вант-Гоффа. Известно, что 1 моль любого недиссоциирующего вещества занимает в водном растворе при 0°С и давлении 10,13×104 Н/м2 (760 мм.рт.ст.) 22,4 л. То есть раствор, содержащий в объеме 22,4 л, 1 моль растворенного недисоциирующего вещества при О°С имеет осмотическое давление 9,8×104 Н/м2. Для того, чтобы в таком растворе осмотическое давление поднять до давления кровяной плазмы (7,4 атм), необходимо вместо 1 моля недиссоциирующего вещества растворить 7,4 моля или 1 моль этого вещества растворить в соответственно меньшем количестве воды: 22.4 / 7.4 = 3.03 л. В полученный результат необходимо внести поправку, т.к. он верен только для 0°С (или 273° по школе абсолютной температуры), а температура тела составляет 37°С (или 310°К). Поэтому 1 моль вещества следует растворять не в 3.03 л, а в несколько большем количестве воды (310·3.03)/273 = 3.44 л. Количество молей вещества при этих условиях будет составлять в 1 л раствора 1 : 3.44 = 0.29. Иначе говоря, чтобы приготовить 1 л изотонического раствора, необходимо взять 0.29 моля лекарственного вещества (неэлектролита) и, растворив в воде, довести объем раствора до 1 л: m = 0.29 M или 0.29 = m / M, где m – количество вещества, необходимое для приготовления 1 л изотонического раствора, г; 0.29 – фактор изотонии вещества-неэлектролита; М – молекулярная масса данного лекарственного вещества. Пользуясь этой формулой, можно рассчитать изотонические концентрации растворов. Например:
Фактор изотонии проще выводится из уравнения Клапейрона-Менделеева: pV = n R T, где p – осмотическое давление кровяной плазмы, атм; V – объем раствора, л; n – число молей растворенного вещества; R – газовая постоянная, выраженная для данного случая в атмосферо-литрах, равная 0.082; Т – абсолютная температура, град. Отсюда: n = pV/RT = (7,4 · 1)/(0,082 · 310) = 0,29. Приведенные расчеты верны, если их проводят для неэлектролитов, т.е. вещества, не распадающиеся при растворении на ионы. В случае электролитов нужно учитывать, что они диссоциируют в водных растворах, и их осмотическое давление будет тем больше, чем выше степень диссоциации. Например, вещество в растворе диссоциировано на 100% NaCl = Na+ + Cl –. В данном случае число элементарных частиц, оказывающих давление, увеличивается вдвое. Если раствор хлорида натрия содержит в 1 л 0.29 моля NaCl, то он имеет осмотическое давление не 7.4 атм., а в 2 раза больше, 14 атм. Следовательно, фактор изотоничности 0.29 к электролитам не применим. Он должен быть уменьшен от степени диссоциации. Для этого в уравнение Клапейрона-Мендеелеева вводится коэффициент изотоничности і, показывающий во сколько раз увеличивается число частиц вследствие диссоциации. Таким образом , уравнение это принимает вид: pV = n R Ti ; n = p V / R Ti , откуда m = 0.29M / i. Коэффициент і зависит от степени и характера электролитической диссоциации и может быть выражен уравнением: і = 1 + α(n – 1), где: α – степень электролитической диссоциации; n – число элементарных частиц, образующихся из одной молекулы при диссоциации. Для различных групп электролитов коэффициент і может быть подсчитан следующим образом. 1. Для бинарных электролитов с однозарядными ионами типа К+А–, (α = 0,86, n = 2) і = 1+ 0,86(2 – 1) = 1,86. 2. Для бинарных электролитов с двузарядными ионами типа К2++А2– (α = 0,50; n = 2) і = 1+ 0,50(2 – 1) = 1,5. 3. Для тринарных электролитов типа К2++А2– и К2++А2– (α = 0,75; n = 3) і = 1+ 0,75(3 – 1) = 2,5. 4. Для слабых электролитов (борная кислота, лимонная кислота и т.д.) і = 1,1. Иногда изотоничность растворов достигается с помощью введения других фармакологически индифферентных веществ. Это бывает в тех случаях, когда основное вещество не обеспечивает изотоничности раствора, тогда прибегают к помощи натрия хлорида, натрия сульфата или натрия нитрата и рассчитывают по формуле:
где М2 – молекулярная масса дополнительного вещества; i2 – изотонический коэффициент дополнительного вещества; m1 – количество основного вещества, г; i1 – изотонический коэффициент основного вещества; М1 – молекулярная масса основного вещества. При составе инъекционного раствора из трех и более компонентов первоначально рассчитывают какой объем могут изотонировать указанные количества всех веществ. Затем определяют по разности, количество дополнительного вещества, чтобы приготовленный раствор был изотоничным. Осмотическое давление многокомпонентного раствора по закону Дальтона складывается из парциальных осмотических давлений отдельных компонентов. Изотонические концентрации могут быть рассчитаны и по криоскопическому методу, основанному на законе Рауля. Закон Рауля определяет зависимость температуры замерзания раствора от концентрации электролитов в нем. Понижение точки замерзания прямо пропорционально количеству вещества, растворенного в данном количестве растворителя: Δ t = К · С, где Δt – депрессия (понижение температуры замерзания) раствора, °С; К – криоскопическая константа растворителя; С – концентрация вещества, моль/л. Изотонические растворы веществ замерзают при одной и той же температуре, т.е. имеют одинаковую температуру депрессии. Температура депрессии сыворотки крови – 0,52°С и, если приготовленный раствор будет иметь депрессию 0,52°, то он будет изотоничен сыворотке крови. Для расчета необходимо знать константы депрессии, предположим 1% растворов лекарственных веществ. Искомую концентрацию изотонического раствора находят по формуле:
Например, для глюкозы (депрессия 1% раствора равна 0.1°), тогда
Общей формулой для расчетов является:
где: m1 – количество вещества, необходимое для изотонирования, г; V – объем, мл; Δt1 – депрессия 1% раствора лекарственного вещества. При расчете многокомпонентных систем пользуются следующими формулами: – при двух компонентах прописи:
– при числе компонентов в прописи более двух:
Наиболее простым и удобным является метод расчета по изотоническим эквивалентам натрия хлорида. Изотоническим эквивалентом вещества по хлориду натрия называется количество хлорида натрия, создающее в одинаковых условиях осмотическое давление, равное осмотическому давлению 1 г данного лекарственного вещества. Например, 1 г безводной глюкозы по осмотическому эффекту эквивалентен 0.178 г хлорида натрия. Это означает, что 1 г безводной глюкозы и 0.178 г хлорида натрия изотонируют одинаковые объемы водных растворов. Или, если, например, эквивалент бромида натрия по хлориду натрия равен 0.62, то это означает, что 1 г бромида натрия и 0,62 г хлорида натрия в одинаковых объемах растворов создают одинаковые осмотические давления. Зная эквивалент лекарственного вещества по натрия хлориду, можно определить его изотоническую концентрацию в растворах. В специальных таблицах приводятся изотонические эквиваленты по хлориду натрия для лекарственных веществ. В случае, когда эквивалент лекарственного вещества неизвестен, необходимо пользоваться другими метода расчета. Стабилизация растворовПри изготовлении и хранении лекарственных препаратов нередко наблюдается изменение их свойств, протекающее с различной скоростью и степенью проявления. Это связано с уменьшением содержания лекарственных веществ или снижением их фармакологической активности, изменением свойств лекарственных форм и т.д. Подобные изменения влияют на срок годности (хранения) препаратов, который может колебаться от нескольких часов (растворы антибиотиков) или дней (растворы ферментов) до нескольких лет. Вопросам стабильности лекарственных средств в настоящее время уделяется большое внимание. Протекающие в препаратах процессы можно условно классифицировать на физические, химические и биологические. Условность заключается в их взаимосвязи: химические превращения могут стать причиной изменения физических свойств, в то время, как физические изменения становятся причиной нежелательных химических процессов. Биологические же процессы сопровождаются как химическими, так и физическими превращениями. К физическим процессам, протекающим преимущественно при хранении, следует отнести укрупнение частиц дисперсной фазы, расслаивание, изменение консистенции, испарение, сублимацию и др. Химические процессы протекают нередко при изготовлении препарата, особенно при термической стерилизации, и сопровождаются разнообразными химическими реакциями – гидролиз, омыление, окислительно-восстановительные процессы, фотохимические и энзиматические превращения, реже наблюдаются полимеризация и изомеризация и др. Биологические процессы, обусловленные жизнедеятельностью микроорганизмов, часто приводят к нежелательным химическим превращениям действующих веществ, иногда – к изменению внешнего вида лекарственной формы. Стабильность лекарственных препаратов зависит от многих факторов – температуры хранения, освещенности, состава окружающей атмосферы, способа приготовления, т.е. технологии лекарственной формы, вспомогательных веществ, вида лекарственной формы, особенно ее агрегатного состояния, упаковки и др. Используемые в настоящее время методы стабилизации лекарственных средств – химический и физический, нередко применяются в комплексе, дополняя друг друга. Химические методы основаны на добавлении химических веществ – стабилизаторов, антиоксидантов и консервантов. Физические методы базируются на защите лекарственных веществ от неблагоприятных воздействий внешней среды, применении лекарственных и вспомогательных веществ высокой степени очистки, использовании современного технологического оснащения и результатов научных исследований в технологии лекарственных форм – применение неводных растворителей, обезвоживание препаратов, ампулирование в токе инертных газов и др. Таким образом, стабильность препарата – это способность биологически активного вещества сохранять физико-химические свойства и фармаколо-гическую активность в течение определенного срока хранения, предусмотренного нормативно-технической документацией. Химические методы стабилизации. Стабилизация гомогенных дисперсных систем основана на подавлении процесса разложения лекарственных веществ за счет связывания или нейтрализации тех химических соединений, которые активируют деструкцию лекарственного вещества. Такие соединения находятся в растворе в незначительных количествах, либо переходят в раствор из упаковки (стекла) при его технологической обработке (стерилизации) и хранении. Стабильность инъекционных растворов, в первую очередь, зависит от качества исходных растворителей и лекарственных веществ, класса и марки стекла ампул и флаконов, наличия кислорода в воде и растворах, рН растворов, температуры и времени стерилизации, наличия ионов тяжелых металлов, условий хранения препаратов и т.д. Основной принцип стабилизации препаратов предусматривает максимальное устранение факторов, способствующих изменению лекарственных веществ. Влияние качества стекла на стабильность веществ. Медицинское стекло представляет собой твердый раствор, полученный в результате охлаждения расплавленной смеси силикатов, оксидов металлов и и некоторых солей. В зависимости от качественного и количественного соотношения оксидов металлов в стекле различают классы и марки медицинского стекла, обладающие различной химической устойчивостью. На поверхности стекла ампул или флаконов при контакте с водными инъекционными растворами во время хранения и особенно при тепловой стерилизации в зависимости от его марки и значения рН раствора может происходить процесс выщелачивания или растворения верхнего слоя стекла. Выщелачивание – это выход из стекла преимущественно оксидов щелочных и щелочноземельных металлов, благодаря высокой подвижности ионов этих металлов по сравнению с высоким зарядом четырехвалентного иона кремния. По этой причине ион натрия даже при комнатной температуре может замещаться другими ионами. При более глубоких процессах выщелачивания ионы щелочных металлов легко перемещаются из внутренних слоев стекла на место ионов, вступивших в реакцию. Выщелачивание из стекла компонентов и их гидролиз ведут к увеличению или уменьшению величины рН раствора. Это приводит к изменениям свойств лекарственных веществ, в основе которых лежат различные химические процессы: гидролиз, окисление, восстановление, омыление, декарбоксилирование, изомеризация и др. Опимальная концентрация водородных ионов в инъекционных растворах является существенным стабилизирующим фактором. Она достигается путем добавления стабилизаторов, которые предусмотрены в нормативно-технической документации, а также использованием комплекса технологических приемов в процессе приготовления парентеральных растворов, о чем будет изложено дальше. Стабилизаторы могут замедлять или ускорять нежелательные химические реакции, создавать определенные значения рН растворов, повышать растворимость лекарственных веществ или удерживать последние во взвешенном состоянии. Выбор стабилизатора, в первую очередь, зависит от природы лекарственных веществ. Среди требований, предъявляемых к стабилизаторам, можно отметить: терапевтическую индифферентность, хорошую растворимость в растворителе, эффективность в применяемых концентрациях, химическую чистоту, доступность. Несмотря на многообразие и чрезвычайную сложность процессов, проходящих в растворах, лекарственные вещества, требующие стабилизации, можно условно разделить на три группы:
Механизм действия стабилизаторовСтабилизация растворов солей слабых оснований и сильных кислот. К этой группе относятся растворы солей алкалоидов азотистых и синтетических азотистых оснований, которые занимают значительное место в ассортименте инъекционных растворов. В зависимости от силы основания растворы имеют нейтральную или слабокислую реакцию. Последняя объясняется гидролизом соли, сопровождающимся образованием слабодиссоциированного основания и сильнодиссоциируемой кислоты, т.е. образующимися ионами гидроксония ОН3+. Это явление усиливается при тепловой стерилизации. Прибавление избытков ионов ОН3+ (т.е. свободной кислоты) понижает степень диссоциации воды и подавляет гидролиз, вызывая сдвиг равновесия влево: Alc HCl + H2O → Alc↓ + OH3+ + Cl – HCl + H2O → OH3+ + Cl – Уменьшение концентрации ионов ОН3+ в растворе вследствие щелочности стекла сдвигает равновесие вправо. Нагревание раствора во время стерилизации увеличивает степень диссоциации воды и повышение рН раствора за счет выщелачивания стекла, вызывает усиление гидролиза соли, что приводит к накоплению в растворе труднорастворимого азотистого основания. В растворах солей очень слабых оснований, малорастворимых в воде, незначительное повышение рН приводит к образованию осадка. Это наблюдается в растворах стрихнина нитрата, папаверина гидрохлорида, дибазола и др. При значительных увеличениях рН раствора (сильно щелочное стекло) иногда наблюдается выделение сильных свободных оснований, например, новокаина. Если основания алкалоидов являются сильными или хорошо растворимыми в воде, то при повышении рН выделение осадка не происходит (основания – эфедрина, кодеина, пилокарпина). Иногда свободное основание не выпадает в осадок, т.к. способно реагировать со щелочью с образованием растворимых продуктов (морфин, апоморфин, адреналин). Кроме того, в слабощелочной среде данные растворы подвергаются окислению с изменением окраски (раствор морфина желтеет, апоморфина – зеленеет, адреналина – розовеет). Если алкалоид или синтетическое азотистое основание имеют сложноэфирные или лактонные группировки (атропин, скополамин, новокаин, дикаин), то при нагревании слабощелочных или нейтральных растворов происходит омыление сложного эфира или лактона, сопровождающееся изменением фармакологического действия. Так, после стерилизации растворов новокаина появляется свободная парааминобензойная кислота, благодаря чему рН раствора смещается в кислую сторону. При уменьшении рН до 8 количество разложившегося новокаина в растворе увеличивается до 11%. В литературе отмечаются сообщения о наличии анилина в растворах новокаина после стерилизации, что объясняется декарбоксилированием парааминобензойной кислоты. Применение новокаина с примесью анилина вызывает повышенную болезненность. Аналогичные процессы образования анилиновых производных отмечены также для дикаина. Выше указанные изменения вызывают необходимость стабилизации растворов многих алкалоидов и азотсодержащих оснований. Большинство из них стабилизируют добавлением 0,1 н раствора кислоты хлористоводородной, которая нейтрализует щелочь, выделяемую стеклом, и смещает рН раствора в кислую сторону. Это создает условия, препятствующие гидролизу, омылению сложных эфиров, окислению фенольных и альдегидных групп. Количество кислоты, необходимое для стабилизации раствора, зависит от свойств лекарственного вещества. Наиболее часто добавляют 10 мл 0,1 н раствора кислоты хлористоводородной на 1 литр стабилизируемого раствора, что соответствует образованию 0,001 н раствора кислоты (рН 3-4). Это количество 0,1 н раствора кислоты хлористоводородной рекомендовано для атропина сульфата, стрихнина нитрата, апоморфина гидрохлорида, кокаина гидрохлорида, дибазола, дикаина и др. Для получения устойчивого раствора новокаина гидрохлорида для инъекций с концентрацией 0,5-2,0% необходимо добавление 0,1 н раствора кислоты хлористоводородной до рН 3,8-4,5, что соответствует 3,4-9,0 мл 0,1 н раствора кислоты на 1 литр раствора. Для приготовления стабильного раствора новокаина (1-2%) на изотоническом растворе натрия хлорида следует добавить 5 мл 0,1 н раствора кислоты хлористоводородной на 1 литр. Для стабилизации растворов веществ со сложной эфирной группировкой (атропин, новокаин и др.) предложено уменьшение количества 0,1 н раствора кислоты хлористоводородной до 3-4 мл на 1 литр раствора. Это связано с тем, что подкисление растворов местных анестетиков приводит к уменьшению их фармакологической активности. При снижении рН растворов от 5 до 3,2 активность новокаина падает в 8 раз. 1-5% растворы морфина гидрохлорида стабилизируют добавлением 10-20 мл 0,1 н раствора кислоты хлористоводородной на 1 литр. Как указывалось выше, морфина гидрохлорид и другие алкалоиды с содержанием фенольных гидроксилов при нагревании, особенно в слабощелочной среде, окисляются. Поэтому, для получения устойчивых растворов необходимо добавление антиокислителей (антиоксидантов), т.е. веществ, препятствующих окислению. Добавлением антиоксидантов стабилизируют растворы адреналина гидротартрата и гидрохлорида, норадреналина гидротартрата, этилморфина гидрохлорида. Стабилизация растворов солей слабых кислот и сильных основний. В водных растворах соли слабых кислот и сильных оснований легко гидролизуются, образуя слабощелочную реакцию среды. Это приводит к образованию труднорастворимых соединений, дающих муть или осадок, что недопустимо для инъекционных растворов. Гидролитические процессы усиливаются в кислой среде, которая может создаваться за счет растворения в воде углерода диоксида. Для подавления реакции гидролиза добавляют 0,1 н раствор натрия гидроксида или натрия гидрокарбоната. Приготовление раствора натрия нитрита проводят с добавлением 2 мл 0,1 н раствора натрия гидроксида на 1 литр (рН 7,5-8,2). Более устойчивые растворы натрия тиосульфата, натрия кофеин-бензоата и теофиллина. Раствор натрия тиосульфата имеет среду, близкую к нейтральной, и при незначительном понижении рН разлагается с выделением серы:
Стабильные растворы получают путем добавления 20,0 г натрия гидрокарбоната на 1 литр (рН 7,8-8,4). При изготовлении растворов натрия кофеин-бензоата следует добавлять 4 мл 0,1 н раствора натрия гидроксида на 1 литр (рН 6,8-8,6). Эуфиллин, являясь комплексной солью очень слабой кислоты (теофиллин) и слабого основания (этилендиамин), легко разлагается в кислой среде, добавление сильной щелочи к раствору эуфиллина также приводит к разложению соли. Для получения стойкого раствора используется эуфиллин сорта «для инъекций» с повышенным содержанием этилендиамина (18-22% вместо 14-18%). Вода для инъекций должна быть освобождена от углерода диоксида путем кипячения. При необходимости оптимальное значение рН раствора поддерживают при помощи буферных растворов, однако, применение их ограничено, т.к. многие из них реагируют с лекарственными веществами в растворе. Буферами и буферными растворами называются растворы, способные сохранять почти постоянное значение рН при добавлении к ним кислоты или щелочи в незначительных количествах. Влияние поверхностно-активных веществ на кинетику химических реакций. Изменение рН среды – не единственный способ защиты лекарственных веществ от гидролиза. В последнее время появились работы по изучению влияния поверхностно-активных веществ (ПАВ) на кинетику химических реакций. Показано, что неионогенные и анионактивные ПАВ тормозят, а катионактивные ПАВ ускоряют процесс гидролиза целого ряда лекарственных веществ. Установлено, что в присутствии ПАВ уменьшение или увеличение скорости реакции обусловлено образованием мицеллоассоциатов молекул ПАВ. Мицеллы ПАВ имеют большие коллоидные размеры и обладают большей объемной емкостью. В пустоты мицелл под влиянием сил межмолекулярного притяжения могут проникать относительно небольшие молекулы лекарственного вещества. Молекулы с гидрофобными свойствами проникают в глубь мицеллы. Гидрофильная молекула занимает положение между отдельными молекулами мицеллы. Гидрофильная молекула лекарственного вещества присоединяется к внешней, наиболее гидрофильной части мицеллы. Образующиеся комплексные соединения обладают большей устойчивостью, чем лекарственные вещества. В связи с этим используют ПАВ для подавления гидролиза лекарственных веществ, например, анестетиков, антибиотиков и др. В каждом конкретном случае использование стабилизаторов требует тщательного изучения при введении их в состав инъекционного раствора. За рубежом стабильные растворы теофиллина для инъекций получают путем добавления аминопропиленгликоля или диметиламинопропиленгликоля (0,75-1,5 г на 1 г теофиллина). Высокомолекулярные соединения (ВМС) также используют для стабилизации натриевых солей барбитуровой кислоты. Для стабилизации фенобарбитала натриевой соли, этаминал-натрия применяют полиэтиленгдиколь, растворы барбамила предлагают стабилизировать добавлением 5% твина-80. Используются и другие пути, позволяющие поддерживать рН в растворе без заметных колебаний. Так как ампульное стекло вызывает изменение рН растворов, то с целью повышения химической стойкости ампул используют силиконовые покрытия внутренней поверхности ампул или защищают стекло пластической массой. Однако, силиконизированные и пластмассовые ампулы до сих пор не нашли широкого применения у нас в стране. Стабилизация растворов легкоокисляющихся веществ. Присутствие кислорода, который находится в растворенном состоянии и в газовом пространстве над раствором в ампуле, является одной из основных причин окисления лекарственных веществ в растворах. Окислению подвергаются многие лекарственные вещества: производные ароматических аминов и фенотиазина, алкалоиды и азотистые соединения с фенольными оксигруппами и аминогруппами, ряд витаминов, а также другие соединения с подвижным атомом водорода. В процессе окисления образуются неативные, а иногда и ядовитые продукты. Скорость окислительных процессов зависит от концентрации кислорода, температуры, рН среды, наличия катализаторов, агрегатного состояния, концентрации веществ в растворе и т.д. Весьма важным фактором, влияющим на скорость окисления, как и на процесс гидролиза, является концентрация водородных ионов, которая может изменяться под влиянием различных марок ампульного стекла. Стекло, используемое для изготовления ампул, оказывает значительное влияние на стабильность лекарственных веществ при хранении. Установлено, что нейтральность стекла, в основном, обуславливается содержанием борного ангидрида, процентное содержание которого в отечественном ампульного стекла марки НС-3 значительно меньше, чем в немецком, американском, чешском. А так как изменения рН раствора в ампулах стекла НС-3, УСП-1 наименьшие по сравнению с другими марками стекла НС-1, НС-2, АБ-1, то для получения стабильных растворов с легкоокисляющимися веществами целесообразно использовать ампулы 1 класса. Теории окислительно-восстановительных процессовМеханизм окислительно-восстановительного процесса раскрыт в перкисной теории А.Н.Баха и И.О.Энглера и теории разветвленных цепей Н.Н.Семенова. Согласно теории цепных реакций, окисление развивается путем взаимодействия молекул исходного вещества со свободными радикалами, которые обращаются под влиянием инициирующих факторов. Свободный радикал начинает цепь окислительных превращений. Он реагирует с кислородом, образуя пероксидный радикал, который с другими молекулами легкоокисляющихся веществ образует промежуточный продукт гидропероксид и новый свободный радикал:
Гидропероксид распадается с образованием свободных радикалов, которые продолжают процесс окисления новых молекул лекарственного вещества. Процесс принимает характер цепных реакций. В ходе окисления может разветвление цепной реакции, в результате чего образуется сложная смесь продуктов окисления:
Исходя из вышесказанного, процесс окисления можно замедлить следующими способами:
Необходимо отметить, что в фармацевтической технологии ингибиторы, прерывающие цепную реакцию, не применяются, т.к. они эффективны только при полном отсутствии кислорода. Механизм действия антиоксидантов. Важное значение имеют стабилизаторы, позволяющие предохранять лекарственные вещества от нежелательного воздействия кислорода, так называемые антиокислители или антиоксиданты. По механизму защиты чувствительных лекарственных веществ различают две группы антиоксидантов:
По происходжению ингибиторы окисления делятся на природные и синтетические. Природные антиоксиданты (АО) выделяют из различных частей растений. По химическому строению большинство применяемых на практике природных АО относится к производным полифенолов. По растворимости АО классифицируются на:
Требования к АО, применяемым в производстве фармацевтичсеких препаратов:
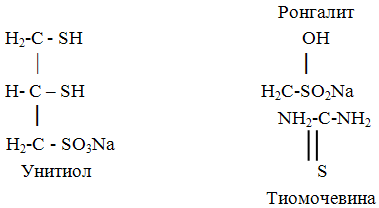
Характеристика группы восстановителей. Восстановители или прямые антиоксиданты подразделяются на несколько групп: 1. Вещества, препятствующие образованию активных радикалов из гидропероксидов. Механизм их действия: RO2' + InH → ROOH + In' InH - антиоксидант с подвижным атомом водорода; In' - малоактивный радикал антиоксиданта. К наиболее эффективным средствам этой группы относятся фенол, аминофенолы, анальгин, парааминофенол, нафтолы, ароматические амины. 2. Вещества, разрушающие гидропероксиды. Они не останавливают цепной процесс окисления, но, снижая скорость разветвления цепей, замедляют окислительные реакции. Тормозящее действие таких восстановителей тем сильнее, чем выше скорость реакции этих веществ с гидропероксидами. Это соли сернистой кислоты, органические соединения серы (натрия сульфит - Na2SO3, натрия метабисульфит - Na2S2O3, натрия бисульфит - NaHSO3, унитиол, ронгалит, тиомочевина и др.).
Органические соединения, содержащие серу – сильные восстановители. Их действие основано на быстром окислении серы. Механизм их действия: ROOH + R'SR ROH + R'2SO ROOH + R'2SO OH + R'2SO2 Негативной стороной этой группы является летучесть и разложение их при стерилизации, которые уменьшаются в среде инертных газов (азота и т.д.). 3. Вещества, обрывающие цепь окисления по реакции с алкильными радикалами. К ним относят хиноны, нитросоединения, молекулярный йод. Учитывая, что кислород очень быстро реагирует с алкильными радикалами, эти ингибиторы малоэффективны. Они эффективны только при недостатке кислорода. Если молекула антиоксиданта содержит несколько функциональных групп, он может оказаться ингибитором смешанного типа, например реагировать с ROOH и RO'2. В то же время, одна и та же группы может реагировать с разными частицами, например, фенолы способны взаимодействовать с перекисными и алкильными радикалами. К восстанавливающим агентам также относятся алкоголи и энолы (хлорбутанол, аскорбиновая кислота и т.д.). Эти вещества имеют низкий редокс-потенциал (например, аскорбиновая кислота – 0,34), т.е. обладают большей интенсивностью окислительно-восстановительных процессов и поэтому окисляются быстрее, чем лекарственные вещества, связывая кислород в растворе и в воздушном пространстве над ним. Однако, для стабилизации раствора аскорбиновой кислоты необходим антиоксидант с еще более низким редокс-потенциалом, например, натрия сульфит (0,19). Многие работы последних лет подвергли сомнению этот механизм действия антиоксидантов. Современное представление действия ингибиторов окисления связывают и с их способностью реагировать со свободными радикалами или препятствовать разложению гидропероксидов на свободные радикалы. Стабилизация масляных растворов. Для стабилизации масляных растворов добавляют жирорастворимые антиоксиданты: бутилокситолуол (БОТ), бутилоксианизол (БОА), α-токоферол, пропилгаллат, аскорбилпальмитат, кислоту нордигидрогваяретовую, кверцетин и их синтетические смеси. Эффективность антиоксидантов этой группы зависит от исходной концентрации гидропероксидов и других продуктов окисления масла. Предложен надежный способ их удаления путем введения в масло вторичных и третичных аминов гидрохлоридов и гидробромидов с последующей термообработкой (предварительной стабилизации), что приводит к почти полному разрушению гидропероксидов. Подобное действие оказывают и некоторые лекарственные вещества – аминазина гидрохлорид, димедрол в концентрациях 10–3 – 10–4 моль/л. Для стабилизации масляных растворов гормональных препаратов в последнее время используют растворы бензил-бензоата. Характеристика отрицательных катализаторов. Антикатализаторы – вещества, способные образовывать прочные внутрикомплексные водорастворимые соединения с большим числом катионов, которые могут переходить в инъекционный раствор из стекла ампул, аппаратуры или могут присутствовать в лекарственном веществе в качестве примесей. Как известно, большое влияние на процесс окисления лекарственных веществ оказывает присутствие следов тяжелых металлов, которые являются катализаторами процессов окисления. Ионы тяжелых металлов (Fe3+; Cu+2; Mn+2 и др.) участвуя в цепной окислительно-восстановительной реакции, способны отрывать электроны от присутствующих вместе с ними в растворах различных ионов, переводя последующие в радикалы: Cu2+ + RCOO– → Cu+ + RCOO– Cu2+ + RCOO– → R' Образовавшийся радикал может реагировать с кислородом, образуя пероксидный радикал, который далее будет участвовать в цепной реакции по приведенной ранее схеме. Частично восстановленный при этом ион металла может легко окислиться кислородом в первоначальную форму, после чего процесс повторяется: O2 Cu+ → Cu2+ Именно цепным характером реакции объясняется, что каталитическое воздействие ионов тяжелых металлов проявляется при наличии их в очень малых количествах. Для получения стабильных растворов необходимо избавиться от них. В настоящее время предложены методы очистки от тяжелых металлов путем фильтрации через слой активированного угля и натриевой формы окисленной целлюлозы, а также образованием неактивных комплексов при максимальном координационном числе металлов или в высшем его валентном состоянии. Для стабилизации легкоокисляющихся веществ используют следующие комплексоны: ЭДТА – этилендиаминтетрауксусная кислота, трилон Б – динатриевая соль этилендиаминтетрауксусной кислоты, тетацин-кальций, кальций-динатриевая соль этилендиаминтетрауксусной кислоты, которые хорошо растворимы в воде, термоустойчивы. Механизм стабилизирующего действия связан с переводом катионов тяжелых металлов в комплексные, практически недиссоциируемые соединения, не активные по отношению к гидроперекиси. Подобным действием обладают гидрохинон, маннит, глицерин, 8-оксихинолин и др. Комплексоны являются косвенными антиоксидантами. Другие способы химической защиты. Комплексная стабилизация. Скорость реакции окисления в значительной степени зависит от значения рН раствора, поскольку ионы гидроксила могут оказывать каталитическое действие. Это объясняется тем, что ион гидроксила под влиянием следов тяжелых металлов может превращаться в радикал, который участвует в цепной реакции окисления: Cu2+ + OH – → Cu+ + OH' OH' + RH → H2O + R' R' + O2 → R–O–O' H2O ↔ OH' + H+ Поэтому для замедления процессов окисления во многие растворы легкоокисляющихся веществ для создания оптимального значения рН добавляют буферные смеси или раствор хлористоводородной кислоты. Возможность окисления (самоокисления) лекарственных веществ понижается с уменьшением концентрации кислорода в растворителе и над раствором. Поэтому растворители, используемые для производства инъекционных растворов должны быть освобождены от кислорода путем кипячения, а также насыщением углерода диоксидом или азотом. Еще одним возможным методом стабилизации легкоокисляющихся веществ может быть использование высокомолекулярных веществ (полиглюкин, пропиленгликоль, полиэтиленоксид с низкой молекулярной массой и др.). В среде этих веществ замедляется окисление, что возможно объяснить проникновение низкомолекулярного лекарственного вещества во внутрь молекулы ВМС и, следовательно, уменьшением их реакционной способности. Окисление может быть уменьшено за счет устранения действия света и температуры. Иногда приготовление некоторых лекарственных средств (например, раствора фенотиазина) целесообразно проводить в красном свете или при хранении использовать ампулы из светозащитного стекла. Скорость протекания деструктивных процессов в лекарственных препаратах увеличивается под влиянием ультрафиолетового излучения. Энергия излучения активирует молекулы или атомы вещества, что в свою очередь вызывает развитие химических реакций, которые могут протекать в газах, твердых веществах и растворах. При поглощении веществом светового излучения определенной волны может происходить ускоренное разложение лекарственных препаратов. Скорость разложения зависит также от агрегатного состояния вещества. Известно, что разложение веществ в сухом виде происходит значительно медленнее по сравнению со скоростью разложения веществ в растворах. Более концентрированные растворы окисляются медленнее, чем разбавленные. Большое значение имеет синергизм ингибиторов, когда действие нескольких веществ превосходит сумму эффекта каждого. Синергизм может быть при совместном введении ингибитора, обрывающего цепь окисления, и ингибитора, разрушающего гидропероксиды. Возможна полифунциональность стабилизатора, который может тормозить окисление как за счет возникновения пероксидного радикала, так и путем разложения гидропероксида. Применение консервантов также способствует повышению стабильности многих препаратов в ампулах. Среди консервантов используются этиловый спирт 95%, нипагин, нипазол, хлорбутанолгидрат, смесь этилового спирта с глицерином и др. Растворы целого ряда легкоокисляющихся веществ не могут приобрести необходимую стойкость при использовании какой-то одной формы стабилизации. В этом случае необходимо использовать сочетание стабилизирующих факторов комбинированной защиты. К стабилизаторам лекарственных форм гетерогенных дисперсных систем (эмульсий и суспензий) можно отнести производные метилцеллюлозы, пектины, альгинаты, бентонитовые глины, аэросил, твины, спены и ряд других веществ. Нередко с целью снижения количества этих веществ и повышения их активности используют различные сочетания стабилизаторов природного, синтетического и полусинтетического происхождения. Физические методы стабилизации ампулированных расторов. Физические методы стабилизации также направлены на максимальное устранение факторов, вызывающих или ускоряющих негативные процессы в инъекционный растворах. К технологическим приемам повышения стабильности растворов в ампулах можно отнести:
Для удаления кислорода из воды можно использовать электролитические, химические и физические методы. Заслуживают внимание некоторые физические методы: удаление кислорода кипячением; барботажем инертнами газами; распылением воды в вакууме; дистилляцией воды в среде углекислого газа или азота. В некоторых случаях возможно использование органических смол для связывания растворенного кислорода. В условиях промышленного производства инъекционные растворов предварительное связывание кислорода в растворителе нерационально, т.к. на последующих технологических стадиях производства растворов в ампулах снова происходит его насыщение. Поэтому более целесообразно удалять его непосредственно перед заполнением ампул. Одним из способов удаления кислорода является метод, основанный на изменении растворимости газов в жидкостях при различных температурах (от 20°С до 100°С), а также использование водяного пара в качестве инертной среды. Принцип ампулирования растворов в среде инертных газов. В газовом пространстве и в растворе содержится достаточное количество кислорода, способствующее окислению растворов лекарственного вещества. Для получения стабильных растворов необходимо максимально заменить воздух на инертный газ в ампуле и удалить кислород из раствора, т.к. растворимость газа в жидкости изменяется в широких пределах в зависимости от газа, растворителя, давления и температуры. При этом раствор предварительно насыщается газом, ампулы непосредственно перед заполнением и запайкой продуваются инертным газом. В качестве инертной среды могут использоваться углекислый газ, азот, аргон. На основании исследований, руководимых проф. Ф.А.Коневым (ГНЦЛС), разработана и внедрена технология ампулирования инъекционных растворов с газовой защитой при использовании вакуумного способа наполнения ампул. Таким образом, устойчивость растворов легкоокисляющихся веществ зависит от многих факторов, а их стабилизация осуществляется путем использования различных технологических приемов и соблюдения ряда условий. Ниже приведены особенности стабилизации некоторых инъекционных растворов. 1. Стабилизация растворов глюкозыИнъекционные растворы глюкозы при стерилизации, особенно в щелочном стекле, подвергаются окислению и карамелизации с изменением цвета раствора. При выборе стабилизатора для раствора глюкозы необходимо учитывать полифункциональный характер этого вещества. Глюкоза неустойчива в щелочной среде, под влиянием кислорода образуются оксикислоты и оксиметилфурфурол. Но она неустойчива и в кислой среде – образуется Д-глюконовая кислота и ее лактоны в результате их окисления образуется 5-оксиметилфурфурол, вызывая пожелтение раствора, что связано с дальнейшей карамелизацией. Растворы глюкозы согластно НТД стабилизируют реактивом Вейбеля:
Стабилизатор Вейбеля добавляют к растворам глюкозы в количестве 5% от объема независимо от ее концентрации. Введение кислоты хлористоводородной к растворам глюкозы предотвращает процессы окисления глюкозы в щелочной среде. Следует отметить, что теоретические вопросы процесса стабилизации глюкозы сложны и еще не достаточно изучены. В настоящее время считают, что натрия хлорид не способствует циклизации глюкозы, а в сочетании с хлористоводородной кислотой создает буферную систему для глюкозы, нестабильной в кислой и нейтральной среде. 2. Стабилизация раствора аскорбиновой кислотыК легкоокисляющимся веществам относятся аскорбиновая кислота, имеющая ендиольную группу с подвижными атомами водорода. При воздействии кислорода она переходит в 2,3-дикетогулоновую кислоту, лишенную С-витаминной активности. В кислых растворах при рН 1,0-4,0 аскорбиновая кислота разлагается с образованием альдегида фурфурола, что обуславливает желтую окраску. Для стабилизации применяют антиоксидант натрия метабисульфит в количестве 2,0 г на 1 л 5% раствора и ампулируют в токе углекислого газа. Стерилизуют текучим паром при 100°С в течение 15 минут. 3. Стабилизация 5, 10 и 20% растворов новокаинаДля стабилизации этих растворов недостаточно введения кислоты хлороводородной до рН 3,8-4,5, поскольку в процессе стерилизации происходит интенсивное окисление. Поэтому используют антиоксиданты, а также их комбинации по прописи:
Приготовление 5% раствора новокаина для спинномозговой анестезии готовят асептически на цитратном буферном растворителе с добавлением в качестве стабилизатора 1,5% поливинола. 4. Стабилизация 10% и 20% раствора натрия-кофеин-бензоата для инъекцийНатрий кофеин-бензоат соль, образованная слабой кислотой и сильным основанием. Стабилизируют 4 мл 0,1н раствора Na гидроксида на 1 л раствора рН 6,8-8,5. 5. Стабилизация 30% раствора сульфацил-натрий для инъекцийСтабилизируют 1н раствором Na гидроксида до рН 7,5-8,5 метабисульфитом натрия (3 г на 1л раствора). 6. Стабилизация 10% суспензии метазидаЕе готовят в асептических условиях путем диспергирования в среде 0.5% раствора КМЦ и консервируют 0,8% хлорбутанолом. 7. Стабилизация 10% раствора желатина для инъекций.Желатин представляет собой высокомолекулярное соединение белковой природы, приготовление которого существенно отличается от других растворов. Для приготовления раствора желатин заливают водой до набухания, плавят и нейтрализуют 1н раствором гидроокиси натрия. После охлаждения производят очистку раствора добавлением 3% активированного угля и яичного взбитого белка. Раствор нагревают до 105°С, отстаивают и добавляют стабилизатор NaCl из расчета 0,5%. Горячий раствор фильтруют через пластинчатые фильтры и разливают в ампулы. Стерилизуют текучим паром при 100°С в течение 20 мин. а затем быстро доводят температуру до 120°С. Натрия хлорид вводят с целью несколько понизить температуру плавления и застудневания желатина. Использование консервантов в производстве препаратов парентерального назначения. Одной из причин снижения качества лекарственных средств является их микробная контаминация в процессе производства или применения, которая может привести к снижению терапевтического эффекта препаратов или развитию у больного различного рода заболеваний. В связи с этим инъекционные лекарственные формы можно применять только при отсутствии в них микроорганизмов, т.е. стерильными. Введение консервантов в растворы проводится в тех случаях, когда сохранение стерильности гарантировать нельзя. Каждое антимикробное вещество, используемое для консервации лекарств, должно обеспечивать безопасность больного и необходимое качество лекарственного препарата. Исходя из этого к консервантам предъявляются следующие требования:
Консерванты не должны снижать фармакологическую эффективность действующего вещества или оказывать токсическое, аллергизирующее и раздражающее действие на организм человека. До настоящего времени не найдено еще не одного химического соединения, которые полностью отвечало бы этим требованиям. Каждый из применяемых консервантов имеет определенные ограничения, поэтому их используют в тех случаях, когда предотвратить контаминацию лекарственных средств другими способами невозможно. В настоящее время принято следующая классификация консервантов:
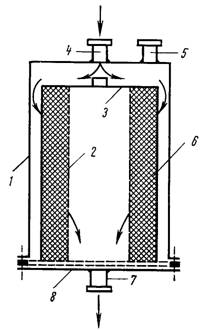
Механизмы воздействия консервантов на микроорганизмы очень различны и определяются их химическим строением. Основным результатом при этом является нарушение жизненных функций клетки, в частности, инактивация белковой части клеточных ферментов. В зависимости от степени инактивации наступает либо гибель клетки, либо замедление ее жизненных функций. Скорость и глубина превращений, протекающих при этом, зависит как от физических (температура, концентрация, фазовое состояние, рН среды и т. д.), так и химических факторов. Немаловажное значение имеет способ фиксации консервантов биологическими средами или объектами, входящими в систему лекарственного средства, в частности, адсорбция на поверхности клетки, на молекулах органических веществ (например, крови), или на мелкодисперсных частицах суспензии. В двух первых случаях явление адсорбции полезно, поскольку представляет собой начальный этап к достижению антимикробного эффекта. В остальных случаях адсорбция приводит к снижению концентрации консерванта в лекарственном препарате, т. е. к ослаблению антимикробной активности. Адсорбция консервантов элементами упаковки имеет место не только в процессе изготовления лекарств, но и при их хранении. Поэтому при определении эффективных для консервирования концентрации антимикробных веществ должны учитываться потери их активности во времени. Среди факторов, ослабляющих антимикробное действие консервантов, следует отметить присутствие в лекарственном средстве неиногенных ПАВ, которые образуют комплексы со многими консервантов, снижают их свободную концентрацию и, соответственно, антимикробный эффект. Для консервирования жидких лекарственных препаратов могут использоваться следующие вещества: бензалкония хлорид, хлорбутол, фенилэтиловый спирт, хлоргексидина диацетат или биглюконат, тиомерсал, сорбиновая кислота, борная кислота, ронгалит, нипагин, нипазол и другие. Лекарственные средства для внутриполосных, внутрисердечных, внутриглазных или других инъекций, имеющих доступ к спинномозговой жидкости, а также при разовой дозе, превышающей 15 мл, не должны содержать консервантов. Перспективным подходом к решению проблемы антимикробной защиты лекарственных препаратов является применение комбинации консервантов. Это позволит расширить спектр антимикробного действия, применять их в более низких концентрациях, предупреждать возможность появления мутантов микроорганизмов. Эффективным оказалось применение фенилэтилового спирта (0,4%), ЭТДА (0,05%) в сочетании с бензалкония хлоридом, хлоргексидина ацетатом, хлорбутолом; смеси бензалкония хлорида и хлоргексидина. Чаще использование консервантов сочетают с другими методами стерилизации (газовой или стерильной фильтрацией) для приготовления в асептических условиях растворов, не требующих тепловой стерилизации. Таким образом, выбор консерванта определяется составом лекарственного средства, рН среды, режимом его применения. Только комплексный подход и строгое соблюдение требований GMр к производству стерильной продукции будет способствовать решению проблемы антимикробной защиты лекарственных препаратов. Фильтрация инъекционных растворовИсточники механических загрязнений инъекционных растворовПрактически загрязнение инъекционных препаратов может происходить на всех стадиях производства. Загрязнения парентеральных препаратов делят на три типа: химические (растворимые), микробные и механические. Два последних типа загрязнений тесно связаны между собой: часто одинаковы их источники, их одновременно показывает большинство современных приборов, аналогичны и методы борьбы с ними. Источники возможных загрязнений имеют широкий диапазон. Основным из них являются: воздух производственного помещения, исходное сырье и растворитель, технологическое оборудование, коммуникации, материалы первичной упаковки (ампулы, флаконы, пробки), фильтрующие перегородки, обслуживающий персонал. Из этих источников в инъекционный раствор могут попасть частицы металла, стекла, резины, пластмасс, угля, волокна асбеста, целлюлозы и т.д. На всех твердых частицах могут быть адсорбированы микроорганизмы. Одним из требований ГФ ХI изд., предъявляемым к препаратам для инъекций, является полное отсутствие механических включений, видимых невооруженным глазом, при производстве растворов в ампулах (малые объемы). Для больших объемов растворов (100 мл и более) фармакопеи США, Великобритании, а также требования Австралии ограничивают содержание даже меньших частиц. Ужесточение требований к чистоте больших объемов растворов связано с тем, что с увеличением объема раствора большее количество механических включений поступает в организм больного. Тяжесть неблагоприятных последствий попадания инородных частиц зависит от их размера, природы и количества. Механические включения, находящиеся в инъекционном растворе, могут привести к образованию тромбов, гранулем, аллергических реакций и других патологических явлений. Так, содержащийся а асбесте хризотил может быть причиной злокачественных новообразований. В больших объемах внутривенных вливаний могут содержаться механические включения в виде волокон целлюлозы и частиц пластмасс, которые являются причиной образования микротромбов в легких. Исходя из вышеуказанного, очевидно, что введение в регламентирующие документы различных стран требований, ограничивающих количества невидимых невооруженным глазом механических частиц, является важным условием, обеспечивающим высокое качество инъекционного раствора. Инструментальный контроль содержания механических примесей в инъекционных растворах стал возможен благодаря использованию оптико-электронных приборов. Для количественной оценки содержания механических включений в жидкостях получил распространение метод фильтрации через мембранные фильтры, который применяется и в нашей стране. Основным недостатком данного метода является его трудоемкость и большая погрешность субъективного измерения. Этих недостатков лишен телевизионный метод, благодаря системе рMS фирмы «Milliрore» для подсчета и измерения частиц, основанный также на процессе фильтрации. Более совершенным устройством для определения содержания количества частиц в растворах являются приборы, основанные на кондуктометрическом и фотоэлектрическом методах регистрации частиц. В нашей стране на основе фотоэлектрического метода разработан счетчик частиц в жидкости типа ГЗ 1. Прибор позволяет измерять частицы диаметром 5-100 мкм. Итак, нормативно-техническая документация предъявляет высокие требования к чистоте инъекционных растворов, что достигается их фильтрованием. Важнейшей частью любого фильтра является фильтровальная перегородка, которая должна задерживать твердые частицы и легко отделяться от них, обладать достаточной механической прочностью, низким гидравлическим сопротивлением и химической стойкостью. Она не должна изменять физико-химические свойства фильтрата. Обеспечивать возможность регенерации, быть доступной и дешевой. Требования, предъявляемые к фильтрам и фильтрующим материалам для инъекционных растворов, значительно выше уже перечисленных. фильтрующие материалы должны максимально защищать раствор от контакта с воздухом; задерживать очень мелкие частицы и микроорганизмы; обладать высокой механической прочностью, чтобы препятствовать выделению волокон и механических включений; противодействовать гидравлическим ударам и не менять функциональные характеристики; не изменять физико-химический состав и свойства фильтрата; не взаимодействовать с лекарственными, вспомогательными веществами и растворителями; выдерживать тепловую стерилизацию. Фильтровальные материалы перед употреблением должны быть обязательно промыты до полного удаления растворимых веществ, твердых частиц или волокон. Выбор фильтрующих перегородок обуславливается физико-химическими свойствами фильтруемого раствора (растворяющая способность жидкой фазы, летучесть, вязкость, рН среды и др.), концентрацией и дисперсностью твердой фазы, требованиями к качеству фильтрата, масштабами производства и т.д. При производстве растворов для инъекций чаще используют тонкое фильтрование как основное или предварительное, предшествующее микрофильтрованию. фильтрующие перегородки, используемые для данной цели, могут задерживать частицы как на поверхности, так и в глубине фильтрующего материала. В зависимости от механизма задержания частиц различают фильтры глубинные (пластинчатые) и поверхностные или мембранные. Глубинное фильтрование. При глубинном фильтровании частицы задерживаются на поверхности и, главным образом, в толще капиллярно-пористого фильтра. Улавливание частиц происходит за счет механического торможения и удержания в месте пересечения волокон фильтрующей перегородки; в результате адсорбции на фильтрующем материале или на участке капилляра, имеющего изгиб или неправильную форму; за счет электро-кинетического взаимодействия. Эффективность фильтра зависит от диаметра, толщины волокна и плотности структуры фильтра. Этот способ фильтрации целесообразно применять для малоконцентрированных суспензий (с объемным содержанием твердой фазы менее 1%, т.к. постепенно происходит закупоривание пор и возрастает сопротивление перегородки). Глубинные фильтры производятся из волокнистого и зернистого матерала, тканых, спрессованных, спеченных или другим образом соединенных, образующих пористую структуру. Примерами волокнистых материалов натурального происхождения могут служить шерсть, шелк, хлопчатобумажные ткани, вата, джут, льняная ткань, асбест, целлюлозное волокно. Среди искусственных волокон можно выделить: ацетатное, акриловое, фторуглеродное, стекловолокно, металлическое и металлокерамическое волокно, нейлон, капрон, лавсан. В фармацевтической промышленности, кроме того, используют бытовые и технические ткани: медаполам, бельтинг, фильтробельтинг, миткаль, фильтромиткаль, хлорин, ткань ФПП, целлюлозно-асбестовые ткани. Из зернистых материалов наиболее распространены диатомит, перлит, активированный уголь и др. Диатомит получают из кремнеземных панцирей водорослей – диатомей. Перлит – это стекловидная горная порода вулканического происхождения, используется, в основном, для изготовления патронных фильтров. Зернистые материалы нашли свое применение для фильтрования трудно фильтруемых жидкостей (биологические жидкости, раствор желатина для инъекций и т.д.). Глубинные фильтры и префильтры, содержащие асбестовые и стеклянные волокна, не должны применяться для парентеральных растворов из-за возможности выделения вредных для организма или труднообнаруживаемых волокон. Большая поверхность адсорбции может привести к потерям действующих веществ на фильтре, а задержание в порах микроорганизмов – к их размножению и загрязненности фильтрата. Поэтому рекомендуется такие фильтры эксплуатировать не более 8 часов. Мембранное фильтрование. Поверхностное фильтрование происходит с образованием осадка на поверхности перегородки. Осадок образует дополнительный фильтрующий слой и постепенно увеличивает общее гидравлическое сопротивление продвижению жидкости. Роль перегородки, в этом случае, состоит в механическом задержании частиц. К этой группе относятся мембранные фильтры. При мембранном или ситовом фильтровании все частицы, имеющие размер больше, чем размер пор фильтра, задерживаются на поверхности. Мембранные фильтры изготовлены из полимерных материалов. Фторопластовые мембраны устойчивы в разбавленных и концентрированных растворах кислот, щелочей, спиртов, эфиров, хлороформа и масел. Hейлоновые и полиамидные – в сильных щелочах и хлороформе. Полиамидные ограниченно совместимы со спиртами. Заводы-изготовители указывают жидкости, не подлежащие фильтрованию, и предельные значение рH, которые выдерживают данный материал. Для ситового фильтрования используют мембраны сетчатого типа, называемые ядерными или капиллярно-пористыми. Такие мембраны производят из прочных полимерных материалов (поликарбонат, лавсан и др.), которые подвергают бомбардировке в ядерном реакторе. Толщина таких фильтрующих перегородок составляет 5-10 мкм. В настоящее время в фармацевтической промышленности за рубежом используют мембраны сетчатого типа фирмы «HУКЛЕПОРЕ» и «ДЖЕЛМАН» (из сополимеров акрилонитрила и винилилденхлорида). Микропористые мембраны используются для очистки растворов, содержащих не более 0,1% твердых частиц. Ситовой эффект мембранных фильтров объясняет быстрое засорение их по сравнению с глубинными. Поэтому для фильтрации инъекционных растворов наиболее перспективным является сочетание обоих типов фильтрующих сред или использование системы серийной фильтрации, когда фильтруемый раствор последовательно прохдит через несколько мембранных фильтров, имеющих прогрессивно уменьшающийся размер пор. Причем мембранные перегородки должны применяться в заключительной стадии очистки, главным образом, для освобождения от мелких частиц и микроорганизмов. Конструкции фильтрующих установок, используемых в производстве инъекционных растворовК поверхностным фильтрующим установкам, работающим под действием гидростатического давления столба жидкости, можно отнести песочные фильтры и фильтр ХHИХФИ. Песочные фильтры представляют собой резервуары с несколькими слоями гравия и кварцевого песка. Применяются преимущественно для очистки воды и в тех случаях, когда содержание твердой фазы невелико. Если же количество твердой фазы значительно – фильтрация производится на тканевых перегородках. Большое распространение получил фильтр ХHИХФИ, предложенный Ф.А.Коневым и Д.Г.Колесниковым (рис. 5.16). фильтр состоит из корпуса и перфорированной катушки-трубы, на которую наматывается до 208 м марли, свернутой в виде слабого жгута.
Рис. 5.16. фильтр ХHИХФИ При намотке полосы марлевого жгута должны плотно прилегать друг к другу до получения требуемой толщины фильтрующего слоя (40-50 мм). Фильтруемая жидкость поступает в патрубок и через слой фильтрующего материала проходит во внутрь катушки-трубы, откуда удаляется через патрубок. Слой марли задерживает частицы размером 10 мкм. Для задержания частиц размером 5-7 мкм в качестве фильтрующего материала могут использоваться синтетические волокна на основе поливинилхлорида, фторопласта, полипропилена. Особенностью данного фильтра является направление потока фильтрации. Фильтруемая жидкость проходит через фильтрующий слой не перпендикулярно, а под углом, что увеличивает путь раствора через фильтр и значительно улучшает качество фильтрата. В заводских условиях предварительную фильтрацию больших объемов инъекционных растворов осуществляют на установках ХHИХФИ, которые последовательно содержат два или несколько фильтров ХHИХФИ и работают под постоянным давлением столба жидкости (не менее 1 м). Регенерацию фильтрующего слоя проводят острым паром в течение 20-30 минут, затем промывают горячей водой. Среди префильтров, работающих под давлением и вакуумированием, используются друк- и нутч-фильтры. Принцип работы и устройства нутч-фильтра лежат в основе фильтра «грибка», который является одной из простейших конструкций, применяемых для фильтрации небольших объемов инъекционных растворов. В настоящее время эти фильтрующие установки используют для предварительной очистки. Окончательную фильтрацию проводят с помощью стерильного фильтрования. Стерильная фильтрация. Под стерильной фильтрацией понимают освобождение растворов термолабильных веществ от микроорганизмов, их спор, продуктов жизнедеятельности (пирогенов) с помощью глубинных и мембранных фильтровальных перегородок. По конструкции фильтрующего элемента различают дисковые и патронные фильтры. Толщина мембран – 50-120 мкм, диаметр пор 0,002-1 мкм. Мембранные фильтры могут работать под вакуумом и давлением. Основное действие микропористых перегородок, применяемых в этих случаях состоит в адсорбции микроорганизмов на большой поверхности, образуемой стенками пор фильтра. Адсорбционная способность фильтров может зависеть от вида микроорганизмов, их концентрации в растворе и условий фильтрования. Стерильной фильтрации обязательно предшествует предварительная очистка раствора для инъекций при помощи глубинных или мембранных фильтров с большим диаметром пор. Префильтры задерживают механические частицы и некоторые «крупные» микроорганизмы. Мембранные фильтры, используемые для стерильной фильтрации, различают по материалу, способу получения пористой перегородки и ее геометрической форме, структурным особенностям пористого мембранного слоя и т.д. По способу получения мембраны классифицируют на ядерные (из макромономерных пленок), пленочные (из растворов и расплавов полимеров), порошковые и волокнистые. В зависимости от используемого материала мембранные фильтры классифицируются на следующие виды: 1. Мембранные фильтры из природных полимеров. Исходным сырьем для их получения являются эфиры целлюлозы. Мембраны этого типа, полученные в форме ленты большой длины, выпускаются в виде плоских дисков. К недостаткам относится их хрупкость, неустойчивость ко всем органическим растворителям (кроме спиртов), ограниченная термостойкость. Поэтому данные мембраны, выпуск которых был организован ранее других, в настоящее время используются ограниченно. Для фильтрации растворов, приготовленных на органических растворителях, используют мембраны из регенерированной целлюлозы, характеризующиеся устойчивостью в органических средах. 2. Мембранные фильтры из синтетических полимеров. Популярность данных фильтров в настоящее время объясняется их достаточной механической прочностью, эластичностью, термоустойчивостью, стойкостью в различных жидких средах. Микрофильтры из синтетических полимеров получают фазоинверсным методом из раствора полимера или методом контролируемого вытягивания, заключающемся в равномерном растягивании во всех направлениях непористой полимерной пленки, например, полипропиленовой или фторопластовой. Мембраны из синтетических полимеров широко используются для производства патронных фильтровальных элементов с гофрированной фильтрующей перегородкой. Изготавливают различные модификации таких мембран, рассчитанных на широкий диапазон фильтруемых объектов. Так, фирма «MILLIрORE» выпускает мембраны из поливинил-идендифторида как с гидрофобными, так и с гидрофильными свойствами, что позволяет использовать их для фильтрации воды, водных растворов и органических сред. Фирмой «рACE» выпускаются двухслойные мембраны из полиамида, обладающие таким уникальным свойством, как природный электро-кинетический потенциал, величина которого зависит от рH среды. Положительный заряд мембран способствует удалению из фильтруемых жидкостей отрицательно заряженных частиц. Это важно для освобождения фильтруемых сред от микроорганизмов и некоторых продуктов их жизнедеятельности, а также микровключений органической природы, т.к. большая часть этих объектов характеризуется отрицательным зарядом. Для фильтрации органических растворителей используются также микрофильтры из политетрафторэтилена, характеризующиеся высокой гидрофобностью. Однако широкое их применение ограничивается сравнительно высокой стоимостью. К этой группе относятся так называемые трековые или ядерные мембраны, получаемые облучением непористой пленки полимера тяжелыми металлами, ионами или осколками деления с последующим химическим травлением треков. Эти мембраны производятся Институтом экспериментальной и теоретической физики АH России и фирмой «NUCLEрORE» в США. Ядерные фильтры имеют равномерно распределенные на его поверхности цилиндрические поры. Для того, чтобы предотвратить возможность слияния двух соседних пор, фирма «NUCLEрORE» выпускает мембраны, поры которых расположены под углом 34° друг к другу. Общеизвестно, что скорость течения вязкой жидкости через капилляр обратно пропорциональна его длине. Ядерные фильтры самые тонкие из всех и имеют небольшую длину капилляра. Ядерные фильтры разрешены Министерством здравоохранения для использования при фильтрационной очистке крови, жидких лекарственных препаратов, растворов белков, вакцин. 3. Волокнистые мембранные фильтры. Получают спеканием полимерных волокон и могут лишь условно быть причислены к мембранным микрофильтрам, поскольку по своей структуре они приближаются к глубинным волокнистым фильтрам. Их небольшая толщина ( ~20 мкм), к сожалению, не обеспечивает требуемой эффективности фильтрации по показателю «стерильность». К относительно новому типу микрофильтров принадлежат мембраны, изготавливаемые в виде полых волокон. Выпускаемые в таких системах фильтровальные элементы представляют собой пучки параллельно уложенных и смонтированных в торцевых фланцах пористых капилляров с размером от 0,1 до 0,45 мкм, что, примерно, в два раза превышает толщину обычных мембран. Hо при этом фильтрующая поверхность патрона высотой 250 мм в 2-4 раза больше поверхности традиционных гофрированных фильтр-патронов. Полые волокна получают продавливанием расплава или раствора полимера через насадку определенной формы. Данный тип микрофильтров может быть весьма перспективным для стерилизующей фильтрации, однако он требует дополнительного исследования. 4. Hаиболее распространенными являются так называемые пленочные мембраны глубинного типа с глобулярно-ячеистыми или глобулярно-фибриллярными порами. Их получают из раствора или расплава полимера с помощью одного из трех методов: сухого, мокрого или смешанного. При сухом формовании растворитель удаляют испарением, при мокром используют осадитель, при смешанном – частичное испарение и осаждение полимера. Пористую структуру иногда получают переводом раствора полимера в отвержденное состояние через стадию образования геля. Удаляя низкомолекулярную фазу и сохраняя первоначальный объем, получают твердый продукт с высокой пористостью. Hаиболее распространенными материалами для изготовления мембран глубинного типа являются различные производные целлюлозы, полиамиды, поликарбонаты, политетрафторэтилен. Мембраны глубинного типа примерно в 10 раз толще сетчатых, поэтому количество адсорбированной ими жидкости будет больше. Однако преимуществом данных фильтров является более низкая скорость забивания и, следовательно, большая экономичность, чем у трековых мембран. Мембраны этого типа выпускаются практически всеми фирмами, занимающимися разработкой и производством мембранных фильтров. Их выпуск налажен в Казани, Таллине и т.д. Hаиболее известны фильтры «ВЛАДИПОР», разработанные ВHИИ синтетических смол. Институтом физико-органической химии Беларуссии разработаны новые микрофильтрационные мембраны для стерилизующей фильтрации из капрона. 5. В последние годы появилось большое количество композитных керамических мембран, получаемых методом порошковой металлургии. Керамические мембраны такого типа, как правило, представляют собой трубу с порами порядка 15 мкм, изготовленную из чистого оксида алюминия, с внутренней стороны которой методом порошковой металлургии или зольно-гелевым способом наносится селективный слой оксида алюминия толщиной 1 мкм с порами от 10 до 0,1 мкм. Керамические мембраны устойчивы в органических и водных средах при различных значениях рH, температур, при перепаде давления и подвергаются регенерации. Однако получение стерильных фильтратов ограничено из-за малой толщины селективного слоя. 6. Металлические мембранные фильтры. К ним относятся мембраны из серебра, получаемые методом порошковой металлургии, выпускаются в форме дисков с размерами пор 5; 3,5; 0,8; 0,2 мкм. Преимуществом данных мембран является их бактериостатическое действие. Серебряные мембраны, к сожалению, являются дорогостоящими, поэтому они применяются лишь в исключительных случаях. Общим недостатком всех мембранных фильтров является их быстрое загрязнение микроорганизмами и вследствие этого, снижение производительности процесса. Предложено несколько способов повышения эффективности фильтрования:
Флокуляция микрочастиц происходит благодаря присутствию электрических зарядов на поверхности частиц. Укрупненные флокулы легко задерживаются на поверхности мембраны; кроме того, концентрационный слой, образованный из них способен задерживать частицы меньших размеров, чем сами флокулы. Подобное взаимодействие происходит между противоположно заряженными частицами и материалом мембраны. Применение ультразвука разрушает концентрационный слой на поверхности мембраны, при этом производительность мембран со временем снижается незначительно, что повышает эффективность процесса очистки. Перспективным направлением борьбы с быстрым забиванием пор является использвание префильтра, серии последовательно расположенных мембран с постепенно уменьшающимися размерами пор, а также применение фильтров с анизотропной структурой. Для предотвращения образования осадка на мембране и закупоривания пор может быть использован метод создания псевдоожиженного слоя над поверхностью фильтра. Для этой цели предложено использовать полистирольные или стеклянные шарики с диаметром 0,3-0,7 мм, при этом проницаемость фильтрата возрастает в два раза. Существенно повысить производительность процесса позволяет создание тангенциального потока у поверхности фильтра, например, за счет вращения фильтрующего элемента. Для стерилизующей фильтрации жидких лекарственных препаратов более предпочтительно использовать фильтрование под давлением, чем вакуумное. Создание давления позволяет повысить производительность процесса, предотвращает подтеки внутри системы и направляет конечный стерильный продукт непосредственно в приемный сборник, предупреждая испарение растворителя. Бактериальные фильтры. К бактериальным фильтрам относятся так называемые керамические свечи, которые имеют вид полых цилиндров из неглазированного фарфора, открытых с одного конца. Их получают спеканием керамических порошков с добавлением связывающих веществ и пластификаторов. Данные фильтры имеют размер пор 5-7 мкм. Фильтрование через них проводят двояко: либо жидкость вводят внутрь фильтра и она, просачиваясь через пористые стенки, вытекает в стерильный сосуд (свечи Шамберлена), либо наоборот, жидкость просачивается через стенки внутрь свечи и оттуда она выводится наружу (свечи Беркефельда). Свечи работают под вакуумом (по типу воронки Бюхнера). Отечественной промышленностью выпускаются керамические свечи – фильтры ГИКИ (разработанные в Государственном институте керамических изделий) разной пористости. Для предварительного фильтрования применяются фильтры Ф1 и Ф2 (размер пор 4,5-7 мкм и 2,5-4,5 мкм соответственно); для стерилизации – Ф11 (0,9 мкм), который задерживает микроорганизмы и бактериальные споры. В связи с прорастанием фильтров (засасывание микроорганизмов внутрь свечи) необходима их периодическая очистка прокаливанием с одновременной стерилизацией сухим паром при температуре 160-170°С в течение 1 часа. Стеклянные фильтры, представляют собой пластинки, сваренные из стеклянных зерен. фильтры с большей величиной пор используются для предварительной фильтрации. Стеклянный фильтр N 5 с размером пор 0,7-1,5 мкм, работающий под вакуумом, применяется для стерильной фильтрации. К группе бактериальных глубинных фильтров можно отнести фильтры Зейтца, а из отечественных – фильтр Сальникова. Фильтрующей перегородкой служат асбестовые пластинки диаметром 300 мм. Чистота раствора для инъекций во время фильтрования может контролироваться с помощью специальных счетчиков частиц проточного или периодического типа. После получения удовлетворительных результатов чистоты раствора по всем показателям он передается на стадию наполнения ампул или флаконов.
Рис. 5.17. Фильтр Сальникова |
||
© Национальный фармацевтический университет, кафедра заводской технологии лекарств |
||
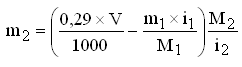
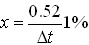 .
.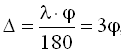 .
.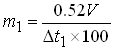
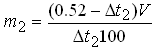 ;
;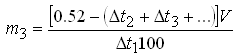 .
.